GxP - GMP, GLP, GDP, GLP : définitions et éléments clés
GxP est un acronyme générique qui couvre les réglementations et directives régissant les bonnes pratiques dans de nombreux secteurs d’activité.
Le “x” de GxP représente un champ d’application spécifique. Dans les industries pharmaceutiques, biotechnologiques et des dispositifs médicaux, on s’intéresse particulièrement aux :
- GMP (Good Manufacturing Practices ; BPF - Bonnes Pratiques de Fabrication en français),
- GDP (Good Distribution Practices ; BPD - Bonnes Pratiques de Distribution),
- GLP (Good Laboratory Practices ; BPL - Bonnes Pratiques de Laboratoire),
- GCP (Good Clinical Practices ; BPC - Bonnes Pratiques Cliniques).
Chacun de ces champs d’application est essentiel pour garantir la qualité, la sécurité et l'efficacité des produits pharmaceutiques tout au long de leur cycle de vie, de la recherche à la distribution.


Good Manufacturing Practices (GMP) ; BPF - Bonnes Pratiques de Fabrication
Les GMP se basent sur les directives de la Food and Drug Administration (FDA) aux Etats-Unis. Elles encadrent la fabrication des produits pharmaceutiques et d’autres produits médicaux pour garantir qu’ils soient fabriqués de manière cohérente et selon des normes de qualité très strictes. Ces pratiques visent à éviter toute contamination, erreurs de fabrication, ou autres défaillances qui pourraient affecter la qualité du produit final.
Les GMP sont imposées par de nombreuses agences de réglementation au niveau mondial, comme la FDA (Food and Drug Administration), l'EMA (European Medicines Agency) et l’OMS (Organisation Mondiale de la Santé).
Eléments clés des GMP :
- Contrôle qualité : Chaque étape de la fabrication des produits pharmaceutiques doit être surveillée, avec des tests et des inspections réguliers des matières premières, des produits intermédiaires et des produits finis.
- Validation des processus : Les processus de production, de nettoyage et d'entretien doivent être validés pour garantir la production d’un produit conforme aux spécifications.
- Formation du personnel : Tout le personnel impliqué dans la production doit être formé de manière adéquate sur les procédures et les normes de qualité.
- Traçabilité : Les GMP imposent une documentation précise et exhaustive pour tracer chaque lot de production, permettant de suivre l'historique complet de fabrication et de distribution en cas de problème.

Eléments clés des GDP :
- Stockage et transport : Les produits doivent être stockés dans des conditions de température et d'humidité strictement contrôlées. Des systèmes de surveillance et de cartographie des zones de stockage, par exemple, sont préconisés pour assurer que les conditions de conservation respectent les normes fixées.
- Traçabilité : Chaque lot de médicament ou de produit pharmaceutique doit être traçable depuis sa fabrication jusqu'à son administration au patient. Cela permet de faciliter les éventuels rappels et de garantir qu'aucune contrefaçon ne pénètre la chaîne d'approvisionnement légitime.
- Formation et qualification du personnel : Les distributeurs doivent s'assurer que le personnel impliqué à chaque étape de la distribution est correctement formé pour manipuler les produits et suivre les procédures GDP.
- Plaintes et rappels : Des procédures doivent être mises en place pour répondre efficacement aux plaintes et organiser des rappels rapides et précis si nécessaire.

Eléments clés des GLP :
- Organisation des études : Les GLP requièrent une définition précise des rôles et responsabilités de chaque membre de l'équipe de recherche, ainsi qu'un plan d'étude détaillé.
- Documentation : Toutes les activités et observations doivent être enregistrées en temps réel et rigoureusement documentées pour permettre une traçabilité complète des données expérimentales.
- Infrastructures et équipements : Les laboratoires doivent être conçus et entretenus de manière à minimiser le risque de contamination. Tous les équipements doivent être régulièrement maintenus et étalonnés selon des procédures conformes pour assurer des résultats fiables.
- Archivage des données : Les données doivent être conservées de manière sécurisée pour permettre des audits par les autorités réglementaires concernées.

Eléments clés des GCP :
- Consentement éclairé : Les participants doivent être informés de tous les aspects de l'essai clinique et donner leur consentement librement avant de participer.
- Protocole d'étude : Chaque essai clinique doit suivre un protocole strict, approuvé par des comités d'éthique, qui décrit en détail les objectifs de l'étude, les critères de participation et les méthodes d'évaluation.
- Qualité des données : Les données recueillies doivent être complètes et conformes à la réalité. Des audits peuvent être réalisés pour vérifier l'intégrité des données recueillies pendant les essais.
- Surveillance et gestion des risques : Les essais cliniques doivent être constamment surveillés pour identifier rapidement les risques ou les incidents qui pourraient affecter la sécurité des participants ou la validité des résultats.
GxP Pharma : l’importance de la surveillance de la température et des autres paramètres environnementaux
La surveillance des paramètres environnementaux est un aspect crucial des GxP pour garantir la qualité des produits pharmaceutiques tout au long de leur cycle de vie. Dickson est un expert mondialement reconnu dans la fabrication, la mise en place et la maintenance de solutions de surveillance des conditions environnementales. Nos Data Loggers, nos logiciels, nos solutions de cartographie, nos laboratoires d’étalonnage et nos procédures rigoureuses jouent un rôle clé dans l'accompagnement des entreprises pharmaceutiques à maintenir la conformité aux GxP, notamment en ce qui concerne la surveillance de la température, de l'humidité, et d'autres paramètres critiques comme le dioxyde de carbone (CO2).
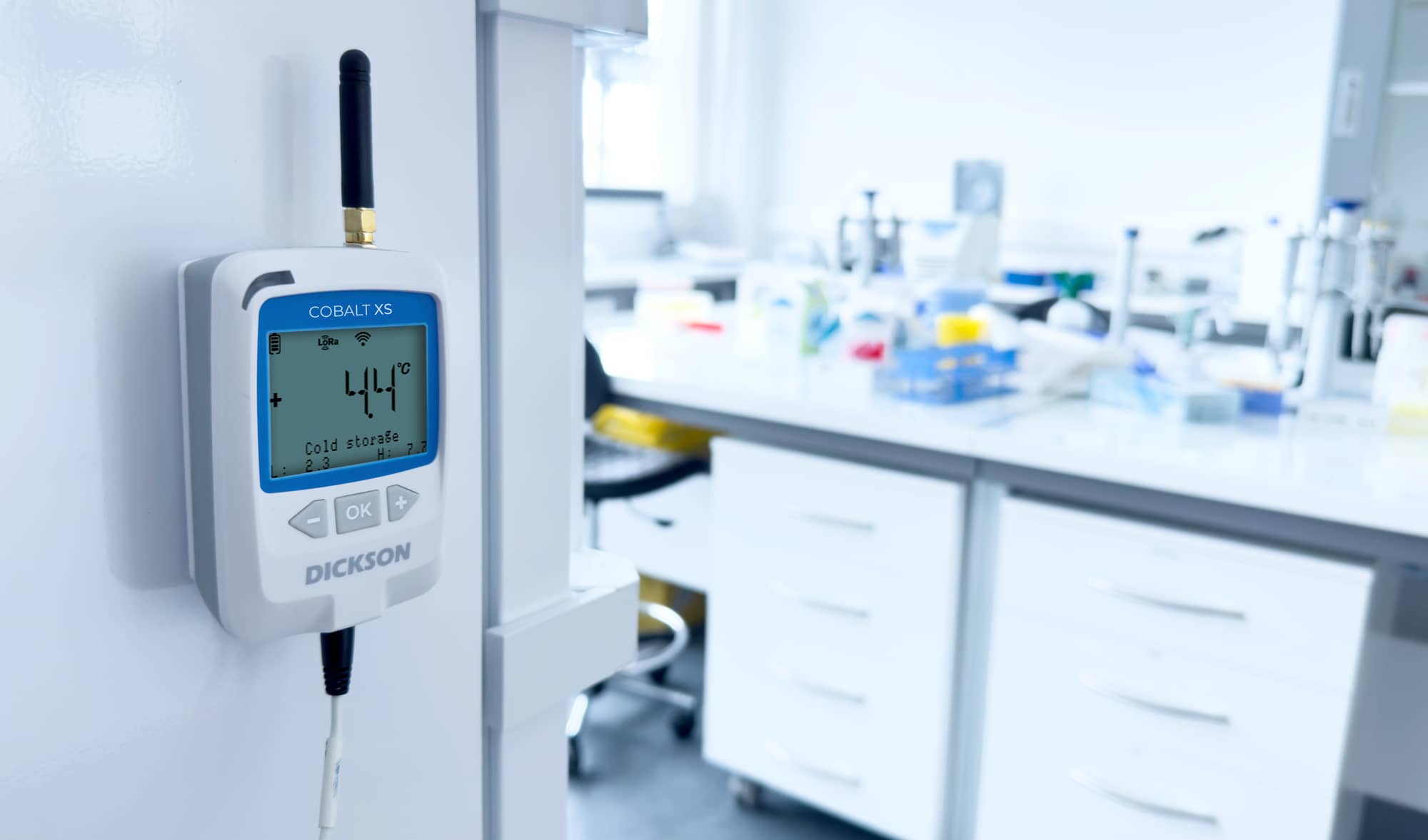
L’expertise de Dickson dans la surveillance environnementale GxP
Dickson propose une gamme complète de produits et services conçus pour répondre aux exigences strictes des directives GMP, GDP, GLP et GCP. Ces solutions incluent des enregistreurs de données (data loggers) connectés, des systèmes de surveillance et d'alerte en temps réel, des laboratoires d’étalonnage accrédités et des logiciels de gestion des données, tous conçus pour offrir une précision et une fiabilité optimales dans des environnements critiques. Grâce à l’utilisation de nos solutions, vous pouvez surveiller et documenter en continu les paramètres environnementaux de vos sites de production, d'entreposage et de distribution.
Température
Les solutions Dickson permettent de cartographier et de surveiller en temps réel les variations de température dans les zones sensibles comme les chambres froides, les entrepôts pharmaceutiques, les incubateurs, les salles blanches ou encore les réfrigérateurs de laboratoire. Ces systèmes de surveillance sont essentiels pour garantir que les produits thermosensibles (vaccins, échantillons biologiques, médicaments injectables, etc.) restent dans des conditions conformes aux études de stabilité. Grâce à leur technologie de pointe, les data loggers Dickson peuvent collecter, enregistrer et transmettre des données précises sur des périodes prolongées, réduisant ainsi les risques liés aux excursions de température.
Humidité
Les enregistreurs Dickson peuvent embarquer des sondes et des capteurs d’humidité, un autre paramètre critique pour les produits sensibles. Nos systèmes de surveillance et nos solutions de cartographie permettent de s'assurer que les conditions d'humidité respectent les exigences de stockage et de production définies par les GMP, minimisant ainsi les risques de dégradation des produits.
CO2 et autres paramètres
Pour les environnements de production ou de laboratoire nécessitant un contrôle strict des niveaux de CO2, comme dans les incubateurs de cultures cellulaires, les solutions de surveillance Dickson intègrent des capteurs de haute précision qui garantissent le respect des normes GLP et GMP. La flexibilité des systèmes de surveillance Dickson permet de personnaliser la configuration en fonction des exigences spécifiques de chaque laboratoire ou site de production. Notre capteur triple intelligent (température, humidité, CO2) simplifie la surveillance de vos équipements les plus exigeants et vous permet de réaliser des économies significatives en termes d’espace, d’installation et de maintenance.
Gestion des excursions de température avec les systèmes de surveillance Dickson
L’un des défis majeurs pour les entreprises pharmaceutiques est la gestion des excursions de température, d’humidité ou de CO2. Les systèmes de surveillance en temps réel de Dickson sont conçus pour détecter rapidement toute excursion et déclencher des alertes automatiques, permettant ainsi aux personnes en charge d’intervenir rapidement pour corriger la situation avant que le produit ne soit compromis.

Alertes en temps réel
Les systèmes Dickson sont dotés de systèmes d’alertes qui avertissent instantanément les équipes responsables lorsque les conditions environnementales sortent des plages prédéfinies. Les procédures d’alertes peuvent être configurées pour envoyer déclencher des alarmes visuels et sonores ou envoyer des notifications par SMS ou e-mail, permettant de réagir rapidement et efficacement et d’éviter les pertes de produits.
Plans d'action correctifs
Les solutions de surveillance Dickson intègrent des SOPs (Standard Operating Procedures) précises pour gérer les excursions. Vous pouvez suivre et documenter les actions correctives nécessaires, comme la correction des paramètres environnementaux, le transfert de produits dans des zones sûres ou l’inspection des lots affectés, conformément aux exigences des GMP, GDP et GLP.
Études de stabilité
Les solutions Dickson permettent également d’étayer les études de stabilité en générant des données précises et conformes qui peuvent être utilisées pour évaluer l’impact potentiel des excursions de température sur la qualité des produits. Cette approche proactive vous aide à optimiser vos processus et à minimiser les risques liés aux fluctuations des paramètres environnementaux.

Documentation et traçabilité conformes grâce à l’expertise de Dickson
Dans le cadre des GxP, la documentation précise et conforme de la surveillance environnementale et des actions correctives entreprises est primordiale. Dickson a développé des solutions logicielles avancées - DicksonOne et OCEAVIew - qui centralisent la collecte et le traitement des données environnementales, facilitant ainsi la traçabilité et la gestion des audits.
Collecte et stockage automatisés des données
Grâce aux logiciels DicksonOne et OCEAView et à leurs enregistreurs de données connectés, vous pouvez enregistrer automatiquement et en temps réel les conditions environnementales de vos produits sensibles, créant ainsi une base de données fiable et conforme aux exigences GxP. Cela permet de réduire le risque d’erreurs humaines et garantit que toutes les données critiques sont stockées de manière sécurisée.
Traçabilité et audits simplifiés
La traçabilité est un aspect fondamental des GxP. Les solutions Dickson permettent aux entreprises pharmaceutiques de démontrer facilement leur conformité aux exigences réglementaires en fournissant des rapports détaillés sur les conditions environnementales et les actions correctives entreprises. Ces données sont archivées de manière conforme pour pouvoir documenter les rapports requis en cas d’inspection des autorités sanitaires ou lors d’audits internes.
Journaux d'événements et actions correctives
Chaque événement, y compris les excursions de paramètres environnementaux et les mesures correctives prises, est soigneusement consigné dans les systèmes Dickson. Cela garantit une conformité rigoureuse, une transparence totale et une capacité à remonter à la source de tout problème potentiel, tout en répondant aux exigences de documentation imposées par les GMP, GDP, GLP et GCP.
Contactez les experts en conformité GxP de Dickson
L’expertise de Dickson en matière de surveillance des paramètres environnementaux et de gestion des excursions contribue de manière significative à la conformité GxP de nombreuses entreprises dans le secteur pharmaceutique. Grâce à nos solutions innovantes, nous aidons les acteurs de l’industrie pharma à garantir la qualité et la sécurité de leurs produits à chaque étape du cycle de vie, depuis la production jusqu'à la distribution. Le respect strict des exigences documentaires et de traçabilité, facilité par les technologies Dickson, permet aux entreprises pharmaceutiques de satisfaire aux audits réglementaires et de maintenir des normes de qualité et de conformité strictes, essentielles pour la sécurité des patients.



